惡性腫瘤(癌症)連續37年盤據我國十大死因第一名,其中,肺癌更是十大癌症之首。癌症治療的棘手之處在於癌細胞發生遠端轉移,由原始的病灶部位轉移到身體其他部位,造成病患後續治療相當困難,預後情形也不盡理想,導致死亡人數持續攀升。因此,癌症的早期診斷與治療,一直是研究及臨床工作者面臨的嚴峻挑戰。
歷經長達六年的時間,國家衛生研究院免疫醫學研究中心主任譚澤華特聘研究員與莊懷佳助研究員研究團隊成功解開GLK蛋白激酶促使癌細胞遠端轉移的關鍵機制,其中,GLK-IQGAP1蛋白質複合體的過量表現及GLK誘發IQGAP1的磷酸化程度,也都與病患存活率有密切關係,未來將能作為肺癌復發轉移的生物標記及標靶分子,可望提供肺癌患者新穎的治療策略。研究成果已發表於2019年10月腫瘤領域權威期刊《癌症研究》(Cancer Research),並獲選為封面故事。
譚澤華特聘研究員與莊懷佳助研究員研究團隊長期致力於探究GLK蛋白激酶與癌細胞產生遠端轉移之間的作用機制,過去與臺中榮民總醫院胸腔外科徐中平主任及李明璟主治醫師共同合作的研究結果指出,GLK蛋白激酶在肺癌及肝癌病患的腫瘤組織中過度表現,並發現與癌細胞產生遠端轉移有關,可預測患者日後癌症復發轉移之可能風險,不過當中的作用機制仍然不清楚。
為此,譚澤華博士研究團隊創建GLK基因轉殖小鼠模型,於GLK轉殖小鼠體內模擬人體癌細胞中GLK蛋白激酶大量表現的狀態,再將GLK轉殖小鼠與肺癌小鼠進行配種。實驗結果發現,原本只出現在肺癌小鼠肺臟中的癌細胞,在GLK轉殖小鼠子代之中,肺癌細胞竟會轉移至淋巴結、肝臟、骨骼及腦部,顯示GLK蛋白激酶過量表現將會誘發肺癌細胞產生遠端轉移的連鎖反應。首先,GLK蛋白激酶與IQGAP1細胞骨架調控蛋白形成「GLK-IQGAP1蛋白質複合體」,GLK蛋白激酶磷酸化並活化IQGAP1,造成肺癌細胞移行,誘發肺癌細胞產生遠端轉移。研究發現,腫瘤組織中的GLK-IQGAP1蛋白質複合體越高,則病患存活率越低,而GLK誘發IQGAP1磷酸化越高,則病患存活率下降更是明顯。因此,GLK-IQGAP1蛋白質複合體及GLK誘發之IQGAP1磷酸化程度,將能作為癌症復發轉移的預測指標及治療標靶。
譚澤華特聘研究員指出,2011年所進行的研究首度發現,調控發炎反應的GLK蛋白激酶為自體免疫疾病的致病關鍵。近幾年,研究團隊陸續發現GLK蛋白激酶過量表現與多種自體免疫疾病與癌症(包含肺癌、肝癌、胰臟癌、腦癌、乳癌、食道癌)有關。譚澤華博士進一步說明,這項研究成果具有極高的臨床應用價值。由於時下熱門的癌症免疫療法,患者在療程中往往會導致自體免疫發炎反應,透過抑制GLK蛋白激酶,不僅可控制癌症復發轉移,同時避免產生自體免疫疾病。特別的是,小鼠實驗發現,GLK基因剔除(等同抑制GLK之效果)小鼠壽命較正常小鼠延長了約1.5倍,表示抑制GLK亦能呈現抗老化之功效。
令人興奮的是,研究團隊已經從現有臨床用藥中鑑定出GLK蛋白激酶之小分子抑制劑,並於2019年10月發表於國際期刊《美國生物實驗學學會聯合會會刊》(FASEB Journal),透過老藥新用來治療自體免疫疾病及癌症復發轉移。此外,GLK-IQGAP1蛋白質複合體之研究成果目前已申請我國、美國以及多國專利,未來亦將持續研發並尋求與國內外藥廠進行技術轉移或藥物產學合作,期盼能為多種癌症轉移及自體免疫疾病的患者提供治療新契機。
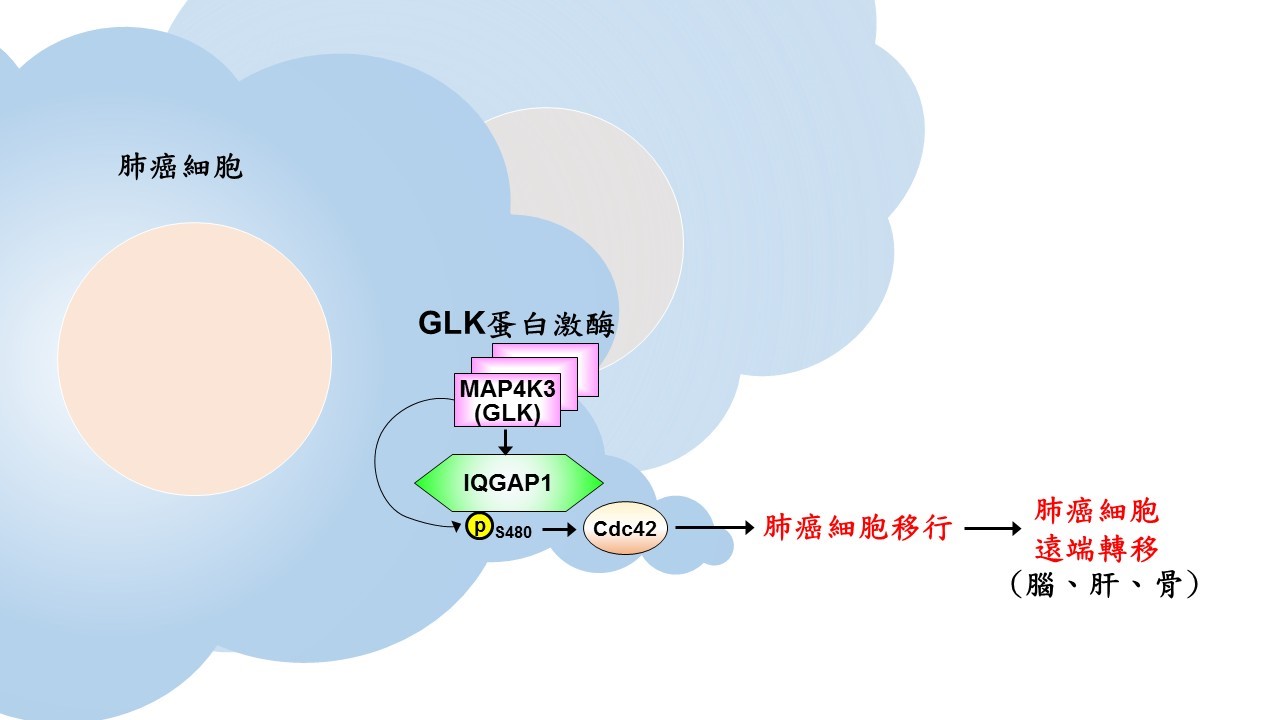
圖說:GLK蛋白激酶於肺癌細胞進行遠端轉移之作用機制
研究論文全文:https://cancerres.aacrjournals.org/content/79/19/4978
