國人罹癌率逐年攀升,癌症在台灣已連續41年位居首要死亡原因,讓人人聞癌色變,近年來隨著對於腫瘤微環境與癌細胞生長機制的研究越發了解,傳統化學療法搭配新穎免疫療法可提高病患存活率和治癒率,逐漸成為抗癌新世代治療方式。
國衛院生醫工程與奈米醫學研究所林淑宜研究員團隊研發新型鉑金抗癌藥物靶鉑TM,並與免疫醫學研究中心林文傑副研究員合作,釐清靶鉑抑制腫瘤血管新生、抑制缺氧誘導因子(HIF-1a)訊號,並進一步減少腫瘤細胞表達PD-L1,增加殺手T細胞進入腫瘤微環境,營造有利對抗腫瘤發展之反應機制。此技術於曾榮獲第十二屆國家新創獎及台北生技獎,並且於今年完備全球 (日、美、加、澳、歐洲及台灣等)多國專利,相關技術已技術移轉,正集資進行毒理及藥理試驗,以遞送臨床試驗申請。
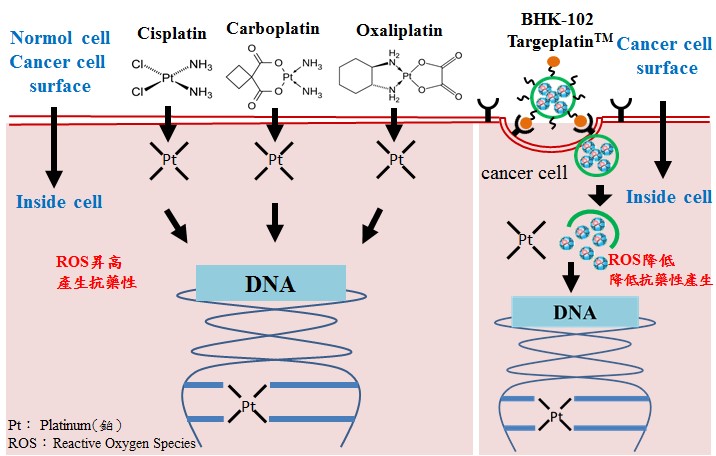
傳統鉑金抗癌藥物雖可阻斷DNA的修復能力,抑制腫瘤細胞生長,然而會同時誘導活性氧化物(ROS)產生,惡化腫瘤微環境進而產生抗藥性。林淑宜研究員團隊於多年前研發出新一代可降低腫瘤表面PD-L1的抗癌新藥靶鉑TM,利用雙重籠狀鉑金奈米團簇複合物(DCPN)技術,只有在腫瘤細胞周邊酸性微環境時才會釋出抗癌活性成分,具有「瞄癌靶向功能」,不會傷及正常細胞,且可避免腎毒性、神經毒性、骨髓抑制等副作用,可以減少癌症患者因為藥物副作用而放棄化療。
腫瘤細胞誘發周邊環境產生慢性發炎反應,因應缺氧環境釋放出的缺氧誘導因子(HIF-1a)訊號,透過增加免疫檢查抑制分子PD-L1的表現誘發免疫T細胞進入耗弱狀態而失去攻擊腫瘤細胞的功能,進而逃避免疫系統的監控!林文傑研究員透過小鼠同源動物腫瘤模式實驗進一步證實,靶鉑在癌細胞中釋放鉑離子阻斷DNA修復時,同樣會產生ROS,但透過靶鉑本身所具有的類酵素功能,可以將ROS轉換成水與氧分子,進而改善局部缺氧,阻斷因缺氧環境的腫瘤血管新生路徑。在PD-1抑制劑合併靶鉑治療中,能減少PD-L1表現,並增加殺手T細胞進入腫瘤微環境,因而降低腫瘤的免疫逃脫,增強癌症免疫治療療效,且腫瘤縮小效果比單一療法更為出色。
靶鉑具有取代第一線鉑金抗癌藥物成為精準有效靶向醫療藥物的潛質,預期對於難纏的肺腺癌和免疫療法藥物不適用健保給付的三陰性乳癌與卵巢癌之治療都有幫助。目前實驗室製程轉移到CMC試量產也已驗證,期待能盡早完成毒理及藥理測試,進入臨床試驗,嘉惠更多癌症病患。