新冠肺炎於全球肆虐超過3年,雖然如今全球疫情趨緩,但仍有許多確診者產生嚴重炎症甚至死亡,即使痊癒後仍有可能罹患長新冠,對於確診者的生活有著長久的嚴重影響。造成確診病患病灶以及死亡的主要原因就是血栓炎症(Thromboinflammation),血栓炎症是指血液凝結結合炎症,在確診病逝者的驗屍檢查中發現,在各個器官中存在富含血小板的血塊和微血管病(小血管異常)。在急性確診者和長新冠患者的血漿中也發現存在持續性微凝塊。然而,新冠病毒誘發血栓炎症的確切分子機制仍不清楚。
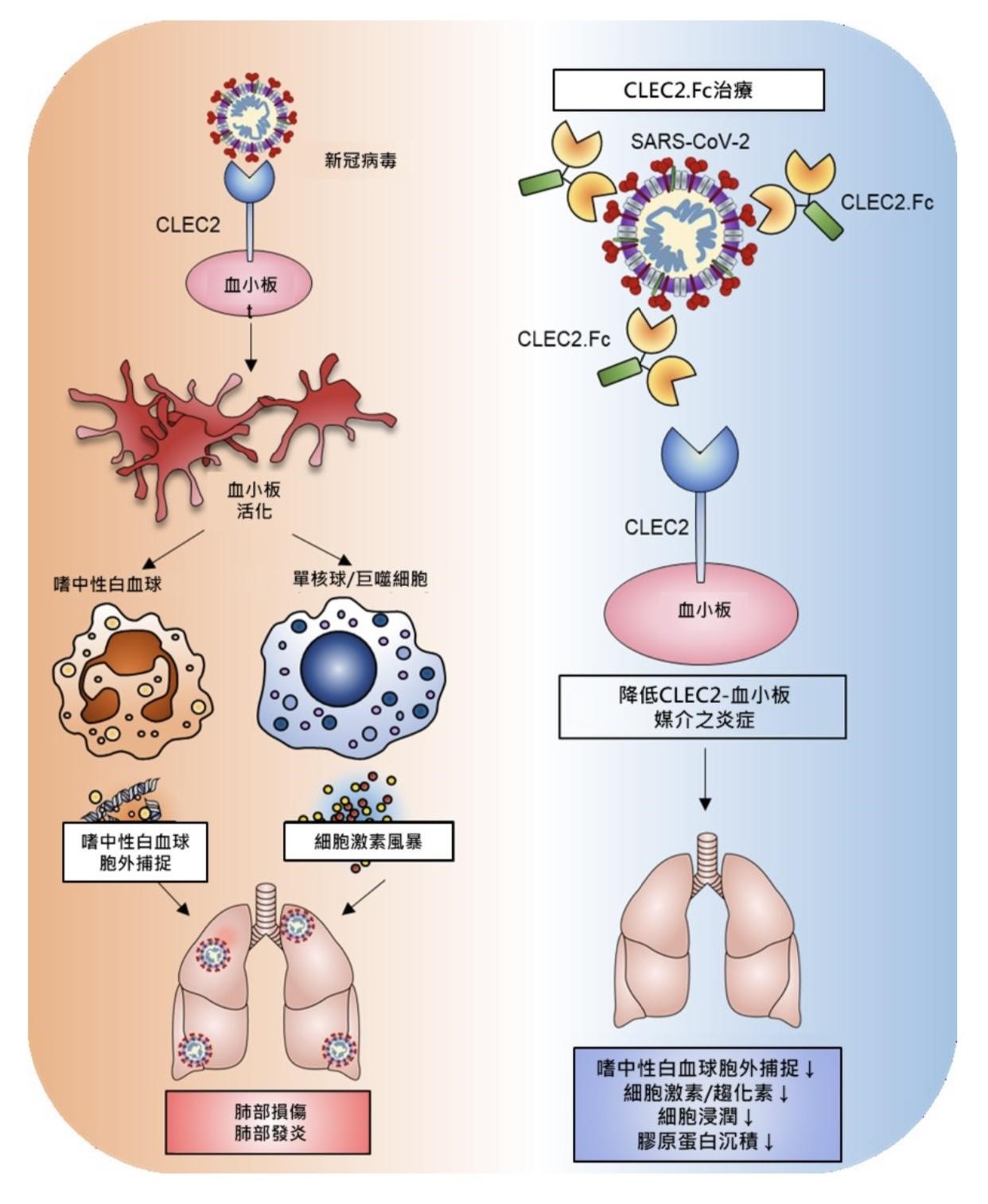
國家衛生研究院免疫醫學研究中心謝世良特聘研究員研究團隊發現,脾臟酪氨酸激酶(Spleen tyrosine kinase,Syk)偶聯C型凝集素受體2 (CLEC2) 與新冠病毒的棘刺蛋白的受體結合域(RBD)有直接的交互作用,引起嗜中性白血球活化產生聚集型(aggregated)嗜中性球胞外捕捉(neutrophil extracellular traps,NETs),進而引發肺部的發炎及損傷。並在動物實驗中證實重組CLEC2蛋白(CLEC2.Fc)能減少小鼠血栓炎症,有望應用於新冠確診者的治療。此研究成果於今(112)年5月發表在國際期刊《EMBO Molecular Medicine》。
CLEC2是在血小板以及肺泡巨噬細胞上大量表現的一種受體,在過去的研究中發現CLEC2與不同病原結合,會活化血小板產生NETs,在不同器官造成微凝塊,進而引發過度發炎反應,與登革熱、腫瘤轉移的機制都有關。研究團隊發現,CLEC2與新冠病毒結合產生的聚集型NETs與以往呈現網狀結構的典型NETs不同,且在缺乏CLEC2血小板的存在下,新冠病毒無法引起NETs。研究團隊進一步利用表現新冠病毒RBD的慢病毒(lentivirus)刺激血小板以及嗜中性白血球,證實新冠病毒是經由RBD與CLEC2結合後活化血小板進而增加NETs產生。
為了評估這些發現的潛在治療意義,研究團隊對感染新冠病毒的小鼠(AAV-hACE2感染小鼠)施打了重組CLEC2蛋白(CLEC2.Fc),發現CLEC2.Fc能夠有效抑制新冠病毒感染後引起之肺部與心臟的NETs,並減少了小鼠的血栓炎症。這表示CLEC2可以作為新冠病毒的新型模式識別受體,而CLEC2.Fc有望作為一種治療劑來對抗新冠病毒引起的血栓炎症,並可能降低急性後遺症(post-acute sequelae of COVID-19,PASC)的風險。